Experimento e questões sobre chuva ácida
Recomendamos ler antes o texto de apoio!
Experimento
Duração: aproximadamente 40 minutos.
Objetivos
Conscientizar o aluno de sua participação na emissão de gases poluentes que aumentam a acidez da atmosfera e conseqüentemente da chuva. Demonstrar a contribuição do SO2 para o aumento da acidez na chuva e discutir sobre a formação da chuva ácida, os malefícios da emissão de SO2, o transporte desse gás, os prejuízos que a chuva ácida causa, e como cada um pode contribuir para minimizar a acidez da chuva.
MATERIAS
- 1 vidro com tampa (como os de maionese ou café solúvel)
- enxofre em pó (1 colher de chá cheia)
- 4 fitas de papel tornassol azul ( ~ 3 cm cada uma)
- 2 pétalas de flor colorida
- 1 colher de plástico
- 2 pedaços de fios de cobre ( ~ 15 cm cada um)
- 1 caixa de fósforos
- 1 caneta
PROCEDIMENTO
- Coloque uma fita de papel tornassol e uma pétala de flor na parte de dentro da tampa do vidro. Utilizando a colher de plástico, polvilhe um pouco do enxofre em pó sobre a fita e sobre a pétala (não utilize todo o enxofre, apenas o suficiente para manchar parte do papel tornassol e da pétala de flor). Anote suas observações na tabela de resultados.
- Coloque cerca de 5 cm de água da torneira no vidro, e com o auxílio da colher (limpa), retire um pouco de água e coloque sobre o enxofre que está sobre a pétala e o papel tornassol. Observe o que acontece com a água em contato com o enxofre, e se houve alteração na cor do papel tornassol e na pétala. Anote suas observações. Jogue no lixo o material sólido da tampa e lave a tampa.
- Pegue uma nova fita de papel tornassol e o umedeça com água. Anote suas observações.
- Monte o seguinte esquema Coloque em uma das extremidades do fio de cobre uma nova pétala e um pouco separado coloque um novo papel tornassol azul. Na outra extremidade do fio, faça um pequeno gancho e pendure por dentro do vidro que já tem um pouco de água. Tome cuidado para que a pétala ou fita não entrem em contato com a água. Veja a ilustração.
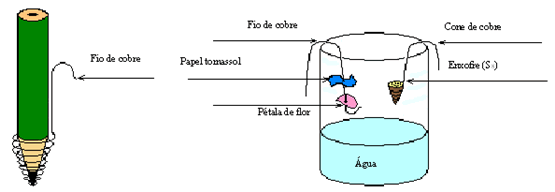
- Pegue o outro fio de cobre e enrole parte deste na ponta da caneta, formando um pequeno cone de cerca de 1 cm. Faça um pequeno gancho na outra ponta do fio, retire a caneta e encha o cone com enxofre em pó, com cuidado (use a colher). Pendure o fio de cobre por dentro do vidro (sem atingir a água).
- Posicione um fósforo aceso abaixo do cone para iniciar a queimar o enxofre e rapidamente retire o fósforo e tampe o vidro. Observe se o enxofre está realmente queimando. Aguarde 5 minutos e anote na tabela de resultados se houve mudança na coloração do papel e da pétala.
- Retire os fios de cobre de dentro do vidro rapidamente. Feche o vidro e agite a solução cuidadosamente.
- Umedeça nova fita de papel tornassol na água e anote suas observações.
PS. O papel tornassol azul é de cor azul em meio neutro e básico e se torna rosa em meio ácido.
NO FINAL DO EXPERIMENTO:
- NÃO JOGUE A ÁGUA ACIDIFICADA NA PIA. Armazene esta solução contendo o ácido sulfuroso em um recipiente grande para posterior neutralização.
- Jogue as pétalas e papel de tornassol no lixo. Os resíduos de enxofre podem ser jogados na pia, pois este elemento é bastante inerte. Lave todo material e retorne-os para sua bancada. Limpe e organize sua bancada.
Tabela de resultados:
|
Observações |
Pétala + enxofre em pó |
|
Papel tornassol + enxofre em pó |
|
Pétala + enxofre em pó + água |
|
Papel tornassol + enxofre + água |
|
Papel tornassol + água |
|
Dióxido de enxofre + pétala |
|
Dióxido de enxofre + papel de tornassol |
|
Dióxido de enxofre + água |
QUESTÕES PARA DISCUSSÃO
- Por que não há alteração na cor da pétala ou do papel tornassol no contato com enxofre em pó e com a água?
- Escreva a equação da reação de combustão do enxofre e a reação do gás produzido com a água.
- Por que após a combustão do enxofre, a pétala e o papel tornassol mudam de cor?
- Por que a água do experimento se tornou ácida?
- O que vem causando o excesso de acidez na chuva de grandes cidades?
- Cite um problema ambiental e um problema de saúde humana que pode ocorrer devido a emissão de dióxido de enxofre na atmosfera.
- Qual a equação que descreve a neutralização do excesso de acidez na chuva pela presença de calcário no solo?
- O que pode ser feito em termos de governo federal para diminuir a acidez, ou a poluição da atmosfera como um todo? E em termos de prefeitura? E você? O que você pode fazer para contribuir para minimizar a sua emissão de contaminantes para a atmosfera?
Desafio 1
Uma propriedade agrícola foi dividida em áreas numeradas de I a IV, de acordo com a acidez da terra. A 25°C, as concentrações hidrogeniônicas, em mol/L, detectadas nos respectivos solos são:
I. [H +] = 1,0 . 10-6
II. [H +] = 2,0 . 10-6
III. [H +] = 1,0 . 10-7
IV. [H +] = 2,0 . 10-8
Quais as duas melhores áreas para o cultivo de plantas que exigem solo neutro ou ligeiramente básico?
Desafio 2
Foi avaliado o pH de um grande número de amostras de água de chuva de uma cidade “A”, que possui uma grande frota automotiva e indústrias. O pH médio foi 4,5. Já para uma cidade remota (cidade B) pouco afetada por atividades antrópicas, o pH médio foi de 5,8. Calcule a diferença média na concentração de H+ da chuva das duas cidades. Por que na cidade “B” que tem baixo impacto humano o pH da água de chuva ainda é menor do que 7,0?